

BLOG
Este Blog tem como propósito compartilhar informações relevantes aos profissionais da área farmacêutica e discutir temas da atualidade. Se você tem interesse em participar com um artigo entre em contato conosco e envie seu texto. Nós iremos avaliar e se for pertinente iremos incluir no nosso site. Podem nos contatar também com sugestões e críticas, todas serão bem-vindas.

VALIDAÇÃO DE MÉTODOS
Quando pensamos em Validação, o que nos vem a cabeça? Tornar ou declarar válido¹, dar validade a¹, desafiar, testar os limites, atribuir confiabilidade a¹.
E método? Processo racional para chegar a um determinado fim², maneira de proceder², sequência lógica de operações, procedimento para realizar um teste ou experimento.
Validação é um termo muito amplo e permeia todas as áreas do conhecimento. Abaixo podemos ver o esquema do processo de validação.
Vamos nos ater neste artigo a Validação dos Métodos Analíticos, no âmbito das Indústrias Farmacêutica, Farmoquímica, Cosmética e Veterinária, o que já é bem amplo, pois envolve diferentes legislações da ANVISA, MAPA e Agências Internacionais ligadas à área.
Uma pergunta pode ser feita: Por que validar?
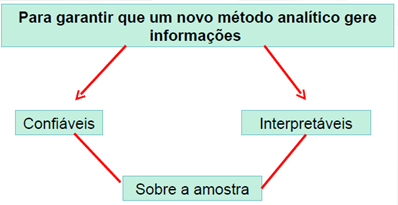
Para iniciar a conversa sobre validação de métodos analíticos, precisamos rever algumas definições de Validação de Método. Este conceito está bem estabelecido nas legislações nacionais e internacionais, como poderemos ver abaixo.
“Validação analítica: é a avaliação sistemática de um método por meio de ensaios experimentais de modo a confirmar e fornecer evidências objetivas de que os requisitos específicos para seu uso pretendido são atendidos”4.
“O objetivo da validação de um procedimento analítico é demonstrar que ele é adequado ao uso pretendido.”4.
"Confirmação por testes e apresentação de evidências objetivas de que determinados requisitos são preenchidos para um dado uso intencional"5.
“A validação de métodos assegura a credibilidade destes durante o uso rotineiro, sendo algumas vezes mencionado como o "processo que fornece uma evidência documentada de que o método realiza aquilo para o qual é indicado para fazer"6.
"Avaliação sistemática de um procedimento analítico para demonstrar que está sob as condições nas quais deve ser aplicado"7.
Podemos citar dois tipos de validação de métodos: realizada em um determinado laboratório (intralaboratorial ou “in house validation”) e a realizada entre dois laboratórios (interlaboratorial), onde se avalia a Reprodutibilidade de um método e as incertezas associadas.
Também podemos classificar a validação como Completa ou Parcial e esta classificação está associada ao tipo de método a ser validado3.
A validação completa é indicada aos métodos não normalizados ou não compendiais e aos desenvolvidos pelo laboratório e a validação parcial, aos métodos normalizados ou compendiais.
Os parâmetros necessários para realização da validação de métodos, no âmbito brasileiro, estão descritos nas Resoluções e Guias da ANVISA.
É importante esclarecer que resoluções são documentos com poder de lei, que devem ser obedecidas e guias são documentos que sugerem uma linha a ser seguida e são, portanto, abertos para interpretação. Os guias são recomendações e são intencionalmente vagos para deixar aos analistas a flexibilidade de adaptá-los de acordo com o método a ser usado8.
É essencial que os estudos de validação sejam representativos e conduzidos de modo que a variação da faixa de concentração e os tipos de amostras sejam adequados9. Os parâmetros indicados pela ANVISA na RDC166/2017 são os seguintes:
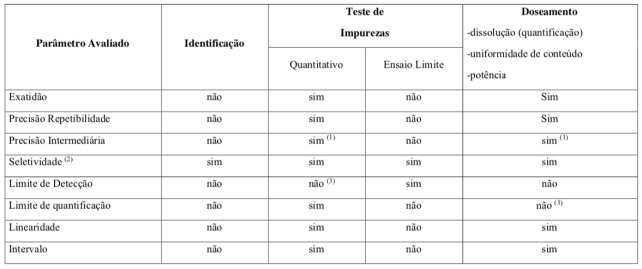
Nos próximos artigos vamos explorar cada um destes parâmetros, de modo a aprofundar o seu entendimento e auxiliar na sua aplicação laboratorial aos diferentes tipos de método.
Antes de se iniciar a validação do método analítico algumas questões precisam ser avaliadas, tais como: materiais de qualidade adequada, padrões de referência farmacopeico ou caracterizados, vidraria Classe A calibrada, pessoal treinado na técnica analítica e nos POPs dos equipamentos e equipamentos calibrados. Com relação ao equipamento, um item é de extrema importância e é parte essencial de um método analítico: Adequação de sistema (System Suitability Test), ‘que pode ser definida como um conjunto de testes para garantir que o equipamento utilizado está apto a gerar resultados de exatidão e precisão aceitáveis’9. Os parâmetros que podem ser avaliados, por exemplo para cromatografia líquida, estão definidos na Farmacopeia Brasileira 5ª ed. <5.2.17.4>10.
Após a validação inicial de um método analítico e ele ter sido submetido a rotina do laboratório, pode surgir a necessidade de o mesmo ser revalidado. De acordo com a ANVISA alguns critérios podem ser seguidos para avaliar a necessidade de revalidação de um método:
– Alteração na síntese da matéria-prima;
– Alterações na composição do produto;
– Alterações no método analítico; e
– Outras alterações que possam impactar na validação do método analítico;
Abaixo vemos um esquema do ciclo de vida de um método analítico.
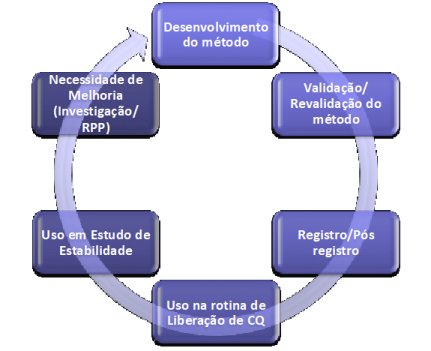
Nos próximos artigos vamos explorar cada um dos parâmetros de validação, de modo a aprofundar o seu entendimento e auxiliar na sua aplicação laboratorial aos diferentes tipos de método. Vamos também explorar a diferença entre validação completa e parcial e as questões práticas e regulatórias envolvidas. Entender como determinar os critérios de aceitação para os diferentes parâmetros e tipos de métodos.
Fonte de pesquisa:
1Significado de Validação. Dicionário do Aurélio Online, 2019. Disponível em: <https://dicionariodoaurelio.com/validacao>. Acesso em: 03 de Aug. de 2019.
2Significado de Método. Dicionário do Aurélio Online, 2019. Disponível em: <https://dicionariodoaurelio.com/metodo>. Acesso em: 03 de Aug. de 2019.
3Resolução ANVISA – RDC166, de 24 de julho de 2017.
4ICH-Q2 (R1) - Validation of Analytical Procedures: Text and Methodology.
5International Standard Organization; General Requirements for the Competence of Testing and Calibration Laboratories, ISO/IEC 17025, 2017.
6United States Pharmacopeia Convention; US Pharmacopeia 42, Validation of Compendial Methods <1225>, Rockville, 2019.
7World Health Organization Expert Committee on Specifications for Pharmaceutical Preparations; Thirty-sixth report, WHO Technical Report Series, No.902, Geneva, 2002.
8Krull, I.; Swartz, M.; LC-GC 1998, 16, 464.
9RIBANI, Marcelo et al. Validação em métodos cromatográficos e eletroforéticos. Quím. Nova, São Paulo, v. 27, n. 5, p. 771-780, Oct. 2004. Available from <http://www.scielo.br/scielo.php?script=sci_arttext&pid=S0100-40422004000500017&lng=en&nrm=iso>. access on 03 Aug. 2019. http://dx.doi.org/10.1590/S0100-40422004000500017.
10Farmacopeia Brasileira 5a ed. Vol. 1.
Artigo escrito por: Evandro D’Ornellas (Bacharel com licenciatura em Química e Consultor)
Data: 09/08/2019.